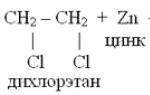Свойства и способы получения алкенов. Алкены. Методы получения алкинов
Министерство образования Р.Ф.
Курская государственная сельскохозяйственная
академия им. Проф. И. И. Иванова
РЕФЕРАТ ПО
Органической химии
ПОЛУЧЕНИЕ АЛКАНОВ, АЛКЕНОВ, АЛКИНОВ.
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ.
ПРИМЕНЕНИЕ В ПРОМЫШЛЕННОСТИ.
Выполнил:
КУРСК-2001
План.
1.1 АЛКАНЫ (предельные углеводороды).
1.2 МЕТОДЫ ПОЛУЧЕНИЯ АЛКАНОВ.
1.3 ПРЕДСТАВИТЕЛИ АЛКАНОВ.
2.1 АЛКЕНЫ (этиленовые углеводороды).
2.2 МЕТОДЫ ПОЛУЧЕНИЯ АЛКЕНОВ.
2.3 ПРЕДСТАВИТЕЛИ АЛКЕНОВ.
3.1 АЛКИНЫ (ацетиленовые углеводороды).
3.2 МЕТОДЫ ПОЛУЧЕНИЯ АЛКИНОВ.
3.3 ПРЕДСТАВИТЕЛИ АЛКИНОВ.
4. ПРИМЕНЕНИЕ АЛКАНОВ, АЛКЕНОВ, АЛКИНОВ.
1.1 ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (алканы).
Предельными углеводородами (алканами) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только Q-связями, и не содержащие циклов. В алканах атомы углерода находятся в степени гибридизацииsp3 .
1.2 Методы получения алканов.
Главным природным источником предельных углеводородов является нефть, а для первых членов гомологического ряда - природный газ. Однако выделение индивидуальных соединений из нефти или продуктов ее крекинга- весьма трудоемкая, а часто и невыполнимая задача, поэтому приходится прибегать к синтетическим методам получения.
1. Алканы образуютсяпри действии металлического натрия на моногалогенпроизводные - реакция Вюрца:
НзС-СН2-Вг + Вг-СН2-СH3 СНз-СН2-СН2-СНз + 2NaBr
Если взяты разные галогенпроизводные, то образуется смесь трех различных алканов, так как вероятность встречи в реакционном комплексе молекул одинаковых или разных равна, а реакционная способность их близка:
3C2H5I + 3CH3CH2CH2IС4Н10 + С5Н12 + С6Н14 + 6NaI
2. Алканы могут быть полученыпри восстановлении алкенов или алкинов водородом в присутствии катализаторов:
НзС-СН=СН-СНзНзС-СН2-СН2-СНз
3. Самые разнообразные производные алканов могут бытьвосстановлены при высокой температуре иодистоводородной кислотой:
CHBr +2HI CH2 + HBr + I2
Однако в этих случаях иногда наблюдается частичная изомеризация углеродного скелета - образуются более разветвленные алканы.
4. Алканы могут быть полученыпри сплавлении солей карбоновых кислот со щелочью. Образующийся при этом алкан содержит на один атом углерода меньше, чем исходная карбоновая кислота:
СНз-С +NaOH CH4+Na2C03
1.3 Представители алканов
Согласно теории строения А. М. Бутлерова, физические свойства веществ зависят от их состава и строения. Рассмотрим на примере предельных углеводородов изменение физических свойств в гомологическом ряду.
Четыре первых члена гомологического ряда, начиная с метана, газообразные вещества. Начиная с пентана и выше, нормальные углеводороды представляют собой жидкости. Метан сгущается в жидкость лишь при -162 °С. У последующих членов ряда температура кипения возрастает, причем при переходе к следующему гомологу она возрастает приблизительно на 25°.
Плотность углеводородов при температуре кипения для нижних членов ряда увеличивается сначала быстро, а затем все медленнее: от 0,416 у метана до величины, несколько большей 0,78.Температура плавления нормальных углеводородов в гомологическом ряду увеличивается медленно. Начиная с углеводорода С16Н34, высшие гомологи при обычной температуре - вещества твердые.
Температура кипения у всех разветвленных алканов ниже, чем у нормальных алканов, и притом тем ниже, чем более разветвлена углеродная цепь молекулы. Это видно, например, из сравнения температур кипения трех изомерных пентанов. Наоборот, температура плавления оказывается самой высокой у изомеров с максимально разветвленной углеродной цепью. Так, из всех изомерных октанов лишь гекса-метилэтап (СН3)3С-С (СНз)3 является твердым веществом уже при обычной температуре (т. пл. 104° С). Эти закономерности объясняются следующими причинами.
Превращению жидкости в газ препятствуют ван-дер-ваальсовы силы взаимодействия между атомами отдельных молекул. Поэтому чем больше атомов в молекуле, тем выше температура кипения вещества, следовательно, в гомологическом ряду температура кипения должна равномерно расти. Если сравнить силы взаимодействия молекул н -пентана и неопентана, то ясно, что эти силы больше для молекулы с нормальной цепью углеродных атомов, чем для разветвленных, так как в молекуле неопентана центральный атом вообще выключен из взаимодействия.
Главным фактором, влияющим на температуру плавления вещества, является плотность упаковки молекулы в кристаллической решетке. Чем симметричнее молекула, тем плотнее ее упаковка в кристалле и тем выше температура плавления (у н -пентана -132° C, у неопентана -20° С)
2.1 АЛКЕНЫ (этиленовые углеводороды, олефины)
Углеводороды, в молекуле которых помимо простых Q-связей углерод - углерод и углерод - водород имеются углерод-углеродные
Связи, называются непредельными. Так как образование -связи формально эквивалентно потере молекулой двух атомсв годорода, то непредельные углеводороды содержат на 2п атомов иодорода меньше, чем предельные, где n число - связей
С6H14C6H12C6H10C6H8C6H6
Ряд, члены которого отличаются друг от друга на (2Н)n, называется изологическим рядом. Так, в приведенной выше схеме изологами являются гексан, гексены, гексадиены, гексины, гексатриены и бензол.
Углеводороды, содержащие одну - связь (т. е. двойную связь), называваются алкенами (олефинами) или, по первому члену ряда - этилену, этиленовыми углеводородами. Общая формула их гомологического ряда - CnH2n
2.2 Методы получения алкенов
При действии спиртовых растворов едких щелочей на галоген производные: отщепляется галогенводород и образуется двойная связь:
H3C-CH2-CH2BrH3C-CH=CH2+NaBr+H2O
Бромистый пропил Пропилен
Если в α-положении к атому углерода, связанному с галогеном, находится третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева):
H3C-C-CI H3C-C + KCL + H2O
2,3-Диметил-3-хлорпентан 2,3-Диметелпентен-2
Это связано с термодинамической устойчивостью образующихся алке-нoв. Чем больше заместителей имеет алкен у винильных атомов углерода, тем выше его устойчивость.
2. Действием на спирты водоотнимающих средств: а) при пропускании спиртов над окисью алюминия при 300-400° С.
НзС-СН-СН2.-СНзНзС-СН=СН-СНз
Втор -Бутиловый спирт
б) при действии на спирты серной кислоты в мягких условияхреакция идет через промежуточное образование эфиров серной кислоты:
НзС-СН-СНз НзС-СН-СН3 H3C-CH=CH2
изопропнлопып спирт
При дегидратации спиртов в жестких условиях в кислых средах наблюдается та же закономерность в отщеплении водородных атомов разного типа, как и при отщеплении галогенводорода.
Первой стадией этого процесса является протонирование спирта, после чего отщепляется молекула воды и образуется карбкатион:
СНз-СН2-СН-СНз + H CH3-CH2-CH-CH3 CH3-CH-CH-
CH3CH3-CH-CH-CH3CH3-CH=CH-CH3
Образовавшийся карбкатион стабилизируется выбросом протона из соседнего положения с образованием двойной связи (β-элиминирование). В этом случае тоже образуется наиболее разветвленный алкен (термодинамическиболее устойчивыи). При этом процессе часто наблюдаются перегруппировки карбкатионов связанные с изомеризацией углеродного скелета:
CH3 C-CH – CH3 CH3 C-CH-CH3
3. При действии Zn или Mg на дигалогенпроизводные с двумя
атомами галогена у соседних атомов углерода:
H3C – C CH2CIH3C - C - CH2+MgCI2
1,2-дихлор-2-метал- изобутилен
4. Гидрированием ацетиленовых углеводородов над катализаторами с пониженной активностью (Fe или «отравленные», т. е. обработанные серусодержащнми соединениями для понижения каталитической активности, Pt и Pd):
НСС-СН(СНз)2Н2С=СН-СН(СНз)2
2.3 Представители алкенов.
Как и алкаиы, низшие гомологи ряда простейших алкенов при обычных условиях - газы, а начиная с С5 - низкокипящие жидкости (см. табл.).
Все алкены, как и алканы, практически нерастворимы в воде и хорошо растворимы в других органических растворителях, за исключением метилового спирта; все они имеют меньшую плотность, чем вода.
3.1 АЛКИНЫ (ацетиленовые углеводороды)
Алкинами называются углеводороды, содержащие кроме Q-связей две
Связи (тройную связь) у одной пары углеродных атомов. Общая формула гомологического ряда ацетиленовых углеводородов СnН2n-2образование одной-связи формально эквивалентно потере двух атомов водорода.
Различными физическими методами доказано, что ацетилен C2H2 - I простейший представитель гомологического ряда алкинов - имеет линейную молекулу, в которой длина углерод-углеродной тройной связи равна 1,20 А, а длина связей углерод-водород 1,06 A.
Связи С-Н в ацетилене относятся к числу Q-связей, образованных путем перекрывапия s-орбитали водорода с гибридизованнойsp- орбиталью углерода; в молекуле имеется одна углерод-углеродная а-связь (образованная перекрыванием двух гибридизованных sp-орби- талей углерода) и две углерод-углеродные -связи - результат перекрывания двух взаимно перпендикулярных пар «чистых» p-орбиталей (р иР ) соседних атомов углерода. Валентные углы в ацетилене на основании этой модели равны 180° и молекула имеет линейную конформацию, что делает невозможной цис-транс- изомерию при тройной связи.
3.2Методы получения алкинов.
Наиболее общим способом получения ацетиленовых углеводородов является действие спиртового раствора щелочей на дигалогенпроиз-водные предельных углеводородов с вицинальным (а) или геминаль-ным (б) расположением атомов галогена
a) CH2Br –CH2Br-> СНСН + 2НВг
б) СНз-СН2-СНСl2-> СHз-ССН+2ИСl
CH3-CH2-CCl2-CH3-> СНз-СС-СНз + 2НС1
Так как вицинальные дигалогенпроизводные обычно получают присоединением галогенов к этиленовым углеводородам, то реакцию (а) можно рассматривать как реакцию превращения этиленовых углеводородов в ацетиленовые.
Геминальные дигалогенпроизводные (оба атома галогена у одного атома углерода) являются производными кетонов или альдегидов и, следовательно, с помощью реакций (б) можно осуществить переход от карбонильных соединений к алкинам. При отщеплении галогенводородов действует уже известное правило Зайцева, что водород отщепляется от углеродного атома, содержащего меньшее количество атомов водорода.
Ацетилен можно получать непосредственно при высокотемпературном крекинге (термическом или электротермическом) метана или более, сложных углеводородов:
2СН4Н-СС-Н + ЗН2
3.3 Представители алкинов.
Как у алканов и алкенов, низшие члены гомологического ряда алкинов в обычных условиях-газообразные вещества. Данные табл. 22 показывают, что основные физико-химические характеристики углеводородов рассмотренных классов мало отличаются друг от друга (см. таблицу).
4. ПРИМЕНЕНИЕ АЛКАНОВ, АЛКИНОВ, АЛКЕНОВ
Алкены вместе с алканами, ацетиленом и ароматическими углеводородами являются одним из главных сырьевых источников промышленности тяжелого (многотоннажного) органического синтеза.
Этилен в громадных количествах используется для переработки в полиэтилен и этиловый спирт, он идет на переработку в этилен-гликоль и употребляется в теплицах для ускорения вызревания плодов.
Пропилен перерабатывается в полипропилен, ацетон, изопропиловый спирт.
Ацетилен играет исключительно важную роль в промышленности. Его мировое производство достигает нескольких миллионов тонн. Громадное количество ацетилена используется для сварки металлов, при его горении
в кислороде температура достигает 2800° С. Это значительно более высокая температура, чем при сгорании водорода в кислороде, не говоря уже о сгорании метана. Причина этого в значительно меньшей теплоемкости СО2 по сравнению с Н2О, которой образуется больше при сгорании алканов, чем алкинов:
2СзН6 + 7O2-> 4СО2 +6Н2О
2С2 Н2+ 5O2-> 4СО2 + ЗН2О
Неприятный запах ацетилена, получаемого из карбида, обусловлен примесями PH3 и AsH3, чистый ацетилен пахнет, как и все низшие углеводороды (бензин). Ацетилен и его смеси с воздухом крайне взрывчаты; ацетилен хранят и транспортируют в баллонах в виде ацетоновых растворов, пропитывающих пористые материалы.
НЕФТЬ И ЕЕ ПЕРЕРАБОТКА
Состав нефти. Главным природным источником предельных углеводородов является нефть. Состав нефтей различается в зависимости от месторождения, однако все нефти при простой перегонке обычно разделяются на следующие фракции: газовая фракция, бензин, реактивное топливо, керосин, дизельное топливо, парафин, нефтяной гудрон.
Газовая фракция (т. кип. до40◦C) содержит нормальные и разветвленные алканы до С, в основном пропан и бутаны. Природный газ из газовых месторождений состоит в основном из метана и этана.
Бензин авиационный (т. кип. 40-180 °С) содержит углеводороды С6 - С10 В бензине обнаружено более 100 индивидуальных соединений, в число которых входят нормальные и разветвленные алканы, циклоалканы и алкилбензолы (арены).
Реактивное топливо (т. кип. 150-280°С).
Керосин тракторный (т, кип. 110-300 °С) содержит углеводороды С7-С14.
Дизельное топливо (т. кип. 200-330 °С), в состав которого входят углеводороды C13 - C18, в больших масштабах подвергается крекингу, превращаясь в алканы (и алкены) с меньшей молекулярной массой (см. ниже).
Смазочные масла (т. кип. 340-400°С) содержат углеводороды C18 - C25.
Парафин нефтяной (т. кип. 320-500 °С), в его состав входят углеводороды С26-С38, из которых выделяют вазелин. Остаток после перегонки обычно называют асфальтом или гудроном.
Помимо углеводородов самых различных классов в нефти содержатся кислородные, сернистые и азотсодержащие вещества; иногда их суммарное содержание доходит до нескольких процентов.
В настоящее время наиболее признанной является теория органического происхождения нефти как продукта превращения растительных и животных остатков. Это подтверждается тем, что в образцах нефтей были найдены остатки порфиринов, стероиды растительного и животного происхождения и так называемый «хемофоссилий» - самые разнообразные фрагменты, содержащиеся в планктоне.
Хотя общепризнанно, что нефть является наиболее ценным природным источником химического сырья, до сих пор основное количество нефти и нефтепродуктов сгорает в двигателях внутреннего сгорания (бензин), дизелях и реактивных двигателях (керосин).
Моторное топливо. Октановое число. Бензины различного происхождения по-разному ведут себя в двигателях внутреннего сгорания.
Стремясь к максимальному повышению мощности двигателя при малых габаритах и массе, стараются увеличить степень сжатия горючей смеси в цилиндре. Однако в быстроходных четырехтактных двигателях, работающих с принудительным зажиганием, при этом иногда происходит преждевременное воспламенение смеси - детонация. Это снижает мощность мотора и ускоряет его износ. Это явление связано с составом жидкого топлива, так как углеводороды разного строения при использовании их в качестве моторного топлива ведут себя различно. Наихудшие показатели - у парафинов нормального строения.
За стандарт горючего вещества с большой способностью к детонации принят нормальный гептан. Чем больше разветвлена углеродная цепь парафинового углеводорода, тем лучше протекает сгорание его в цилиндре и тем большей степени сжатия горючей смеси можно достичь. В качестве стандарта моторного топлива принят 2, 2, 4-триметилпентан (который обычно называют изооктаном) с хорошими антидетонационными свойствами. Составляя в различных пропорциях смеси этого октана с я-гептапом, сравнивают их поведение в моторе с поведением испытуемого бензина. Если смесь, содержащая 70% изооктана, ведет себя так же, как исследуемый бензин, то говорят, что последний имеет октановое число 70 (октановое число изооктана принято за 100; октановое число н -гептана принято равным нулю).
Одним из путей повышения детонационной стойкости топлив для двигателей с зажиганием от искры является применение антидетонаторов.
Антидетонаторы - это вещества, которые добавляют к бензинам (не более 0,5%) для улучшения аптидетопацнонных свойств. Достаточно эффективным антидетонатором является тетраэтилсвинец (ТЭС) РЬ (C2H5)4
Однако бензин с ТЭС и продукты его сгорания очень токсичны. В настоящее время найдены новые антидетонаторы на основе марганец-органических соединений типа циклопентадиеиклпснтакарбонилмарганца С5Н5Мn (СО)5: они менее токсичны и обладают лучшими антидетонационными свойствами. Добавление этих антидетонаторов к хорошим сортам бензина позволяет получать топливо с октановым числом до 135.
Для ракетных и дизельных двигателей, наоборот, наиболее ценны топлива с нормальной цепью углеродных атомов, обладающие наиболее низкой температурой воспламенения. Эту характеристику принято
оценивать в цетановых числах. Цетановое число 100 имеет углеводород н-Сц, Нд4, а цетаповое число 0 - 1-метилнафталин.
Синтез углеводородовиз CO+H2.Пропуская над мелко раздробленнымникелем смесь окиси углерода (II) и водорода при 250° С, можно получитьметан:
СО+ЗН2СН4+Н2О
Если эту реакцию проводить при давлении 100-200 атм и температуре до 400°С, получается смесь, состоящая главным образом из кислородсодержащих продуктов, среди которых преобладают спирты; смесь эта была названа счшполом .
При применении железо-кобальтовых катализаторов и температуре 200° С образуется смесь алканов - синтин.
nСО + (2n + 1) Н2 СnН2n +2 + H2О
Синтин и синтол являются продуктами многотоннажного органического синтеза и широко используются в качестве сырья для многих химических производств.
Клатраты. Синтин и бензиновые фракции нефти состоят из смесей углеводородовнормального строения и с разветвленными цепями. Недавно был найден эффективный метод разделения органических соединений с нормальными цепями и разветвленных, получивший в общем случае название метода клатратного разделения. Для разделения углеводородовбыла использована мочевина. Кристаллы мочевины построены таким образом, что внутри кристаллов имеются узкие шестигранные каналы. Диаметр этих каналов таков, что внутрь их может пройти и задержаться за счет адсорбционных сил только углеводород нормального строения. Поэтому при обработке смеси органических соединений мочевиной (или некоторыми другими соединениями) вещества с нормальной цепью углеродных атомов кристаллизуются вместе с ней в виде комплексов. Этот метод имеет, безусловно, очень большое будущее - когда будет найдено большее число эффективных клатратообразователей.
«___»_____________2011г. Урок 13
Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
углубить и конкретизировать понятия о пи-связи, о механизмах химических реакций;
дать первоначальные представления о реакциях полимеризации и строении полимеров;
разобрать лабораторные и общие промышленные способы получения алкенов;
продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO 4 , этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
ХОД УРОКА
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
Какие углеводороды называются алкенами?
Каковы особенности их строения?
В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C
8
H
18
––>
C
4
H
8
+ C
4
H
10
; (термический крекинг при 400-700
o
С)
октан
бутен
бутан
– дегидрирование алканов C
4
H
10
––> C
4
H
8
+ H
2
; (t, Ni)
бутан
бутен
водород
– дегидрогалогенирование галогеналканов C
4
H
9
Cl + KOH ––> C
4
H
8
+ KCl + H
2
O;
хлорбутан
гидроксид
бутен
хлорид вода
калия
калия
– дегидрогалогенирование дигалогеналканов

– дегидратация спиртов С
2
Н
5
ОН ––> С
2
Н
4
+ Н
2
О (при нагревании в присутствии концентрированной серной кислоты)
Запомните!
При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород преимущественно отрывается от менее гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи определяет тип химических реакций, в которые вступают органические вещества. Наличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения олефинов;
– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной
- и одной
-связи, которая достаточно легко поляризуется.
Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.

Запомни! Возможны следующие механизмы разрыва -связи:
а) если алкены и реагент – неполярные соединения, то -связь разрывается с образованием свободного радикала:
H 2 C = CH 2 + H : H ––> + +
б) если алкен и реагент – полярные соединения, то разрыв -связи приводит к образование ионов:
в) при соединении по месту разрыва -связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
– реакция полимеризации nCH
2
= CH
2
––> n – CH
2
– CH
2
–– > (– CH
2
– CH
2
–)n
этен
полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства (инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной серной кислоты, 1 мл спирта и небольшое количество песка.
2. Закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с перманганатом калия. Обратите внимание на изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки. Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
CH 3 – CH = CH 2 + 4 [O] ––> CH 3 COOH + HCOOH
– каталичесикое окисление
Запомните главное!
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что
- связь под действием реагентов легко разрывается.
3. В результате присоединения происходит переход атомов углерода из sp
2
– в sp
3
- гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала

Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
- рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
- углубить и конкретизировать понятия о?-связи, о механизмах химических реакций;
- дать первоначальные представления о реакциях полимеризации и строении полимеров;
- разобрать лабораторные и общие промышленные способы получения алкенов;
- продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO 4 , этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
ХОД УРОКА
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
- Какие углеводороды называются алкенами?
- Каковы особенности их строения?
- В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C 8 H 18 ––> C
4 H
8
+ C 4 H 10 ; (термический крекинг при 400-700 o С)
октан
бутен
бутан
– дегидрирование алканов C 4 H 10 ––> C 4 H 8
+ H 2 ; (t, Ni)
бутан
бутен
водород
– дегидрогалогенирование галогеналканов C 4 H 9 Cl
+ KOH ––> C 4 H 8 + KCl
+ H 2 O;
хлорбутан
гидроксид бутен
хлорид
вода
калия
калия
– дегидрогалогенирование дигалогеналканов 
– дегидратация спиртов С 2 Н 5 ОН ––> С 2 Н 4
+ Н 2 О (при нагревании в присутствии
концентрированной серной кислоты)
Запомните!
При реакиях
дегидрирования, дегидратации,
дегидрогалогенирования и дегалогенирования
нужно помнить, что водород преимущественно
отрывается от менее гидрогенизированных атомов
углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи
определяет тип химических реакций, в которые
вступают органические вещества. Наличие в
молекулах этиленовых углеводородов двойной
углерод – углеродной связи обуславливает
следующие особенности этих соединений:
– наличие двойной связи позволяет отнести
алкены к ненасыщенным соединениям. Превращение
их в насыщенные возможно только в результате
реакций присоединения, что является основной
чертой химического поведения олефинов;
– двойная связь представляет собой значительную
концентрацию электронной плотности, поэтому
реакции присоединения носят электрофильный
характер;
– двойная связь состоит из одной - и одной -связи, которая достаточно легко
поляризуется.
Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.

Запомни! Возможны следующие механизмы разрыва -связи:
а) если алкены и реагент – неполярные соединения, то -связь разрывается с образованием свободного радикала:
H 2 C = CH 2 + H: H ––> + +
б) если алкен и реагент – полярные соединения, то разрыв -связи приводит к образование ионов:
в) при соединении по месту разрыва -связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
– реакция полимеризации nCH 2 = CH 2
––> n – CH 2 – CH 2 –– > (– CH 2 – CH 2
–)n
этен
полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства (инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной
серной кислоты, 1 мл спирта и небольшое
количество песка.
2. Закройте пробирку пробкой с газоотводной
трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с
перманганатом калия. Обратите внимание на
изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки.
Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
CH 3 – CH = CH 2 + 4 [O] ––> CH 3 COOH + HCOOH
– каталичесикое окисление
Запомните главное!
1. Непредельные углеводороды активно вступают в
реакции присоединения.
2. Реакционная активность алкенов связана с тем,
что - связь под
действием реагентов легко разрывается.
3. В результате присоединения происходит переход
атомов углерода из sp 2 – в sp 3 -
гибридное состояние. Продукт реакции имеет
предельный характер.
4. При нагревании этилена, пропилена и других
алкенов под давление или в присутствии
катализатора их отдельные молекулы соединяются
в длинные цепочки – полимеры. Полимеры
(полиэтилен, полипропилен) имеют большое
практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала

Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Министерство образования Р.Ф.
Курская государственная сельскохозяйственная
академия им. Проф. И. И. Иванова
РЕФЕРАТ ПО
Органической химии
ПОЛУЧЕНИЕ АЛКАНОВ,АЛКЕНОВ,АЛКИНОВ.
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ.
ПРИМЕНЕНИЕ В ПРОМЫШЛЕННОСТИ.
Выполнил:
КУРСК-2001
План.
1.1 АЛКАНЫ (предельные углеводороды).
1.2 МЕТОДЫ ПОЛУЧЕНИЯ АЛКАНОВ.
1.3 ПРЕДСТАВИТЕЛИ АЛКАНОВ.
2.1 АЛКЕНЫ (этиленовые углеводороды).
2.2 МЕТОДЫ ПОЛУЧЕНИЯ АЛКЕНОВ.
2.3 ПРЕДСТАВИТЕЛИ АЛКЕНОВ.
3.1 АЛКИНЫ (ацетиленовые углеводороды).
3.2 МЕТОДЫ ПОЛУЧЕНИЯ АЛКИНОВ.
3.3 ПРЕДСТАВИТЕЛИ АЛКИНОВ.
4. ПРИМЕНЕНИЕ АЛКАНОВ, АЛКЕНОВ, АЛКИНОВ.
1.1 ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (алканы).
Предельными углеводородами (алканами) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только Q-связями, и не содержащие циклов. В алканах атомы углерода находятся в степени гибридизацииsp3 .
1.2 Методы получения алканов.
Главным природным источником предельных углеводородов является нефть, а для первых членов гомологического ряда - природный газ. Однако выделение индивидуальных соединений из нефти или продуктов ее крекинга- весьма трудоемкая, а часто и невыполнимая задача, поэтому приходится прибегать к синтетическим методам получения.
1. Алканы образуются при действии металлического натрия на моногалогенпроизводные - реакция Вюрца:
НзС-СН2-Вг + Вг-СН2-СH3 СНз-СН2-СН2-СНз + 2NaBr
Если взяты разные галогенпроизводные, то образуется смесь трех различных алканов, так как вероятность встречи в реакционном комплексе молекул одинаковых или разных равна, а реакционная способность их близка:
3C2H5I + 3CH3CH2CH2IС4Н10 + С5Н12 + С6Н14 + 6NaI
2. Алканы могут быть получены при восстановлении алкенов или алкинов водородом в присутствии катализаторов:
НзС-СН=СН-СНзНзС-СН2-СН2-СНз
3. Самые разнообразные производные алканов могут быть восстановлены при высокой температуре иодистоводородной кислотой:
CHBr +2HI CH2 + HBr + I2
Однако в этих случаях иногда наблюдается частичная изомеризация углеродного скелета - образуются более разветвленные алканы.
4. Алканы могут быть получены при сплавлении солей карбоновых кислот со щелочью. Образующийся при этом алкан содержит на один атом углерода меньше, чем исходная карбоновая кислота:
СНз-С +NaOH CH4+Na2C03
1.3 Представители алканов
Согласно теории строения А. М. Бутлерова, физические свойства веществ зависят от их состава и строения. Рассмотрим на примере предельных углеводородов изменение физических свойств в гомологическом ряду.
Четыре первых члена гомологического ряда, начиная с метана, газообразные вещества. Начиная с пентана и выше, нормальные углеводороды представляют собой жидкости. Метан сгущается в жидкость лишь при -162 °С. У последующих членов ряда температура кипения возрастает, причем при переходе к следующему гомологу она возрастает приблизительно на 25°.
Плотность углеводородов при температуре кипения для нижних членов ряда увеличивается сначала быстро, а затем все медленнее: от 0,416 у метана до величины, несколько большей 0,78 .Температура плавления нормальных углеводородов в гомологическом ряду увеличивается медленно. Начиная с углеводорода С16Н34, высшие гомологи при обычной температуре - вещества твердые.
Температура кипения у всех разветвленных алканов ниже, чем у нормальных алканов, и притом тем ниже, чем более разветвлена углеродная цепь молекулы. Это видно, например, из сравнения температур кипения трех изомерных пентанов. Наоборот, температура плавления оказывается самой высокой у изомеров с максимально разветвленной углеродной цепью. Так, из всех изомерных октанов лишь гекса-метилэтап (СН3)3С-С (СНз)3 является твердым веществом уже при обычной температуре (т. пл. 104° С). Эти закономерности объясняются следующими причинами.
Превращению жидкости в газ препятствуют ван-дер-ваальсовы силы взаимодействия между атомами отдельных молекул. Поэтому чем больше атомов в молекуле, тем выше температура кипения вещества, следовательно, в гомологическом ряду температура кипения должна равномерно расти. Если сравнить силы взаимодействия молекул н -пентана и неопентана, то ясно, что эти силы больше для молекулы с нормальной цепью углеродных атомов, чем для разветвленных, так как в молекуле неопентана центральный атом вообще выключен из взаимодействия.
Главным фактором, влияющим на температуру плавления вещества, является плотность упаковки молекулы в кристаллической решетке. Чем симметричнее молекула, тем плотнее ее упаковка в кристалле и тем выше температура плавления (у н -пентана -132° C, у неопентана -20° С)
2.1 АЛКЕНЫ (этиленовые углеводороды, олефины)
Углеводороды, в молекуле которых помимо простых Q-связей углерод - углерод и углерод - водород имеются углерод-углеродные
Связи, называются непредельными. Так как образование -связи формально эквивалентно потере молекулой двух атомсв годорода, то непредельные углеводороды содержат на 2п атомов иодорода меньше, чем предельные, где n число - связей
С6H14C6H12C6H10C6H8C6H6
Ряд, члены которого отличаются друг от друга на (2Н)n, называется изологическим рядом. Так, в приведенной выше схеме изологами являются гексан, гексены, гексадиены, гексины, гексатриены и бензол.
Углеводороды, содержащие одну - связь (т. е. двойную связь), называваются алкенами (олефинами) или, по первому члену ряда - этилену, этиленовыми углеводородами. Общая формула их гомологического ряда - CnH2n
2.2 Методы получения алкенов
При действии спиртовых растворов едких щелочей на галоген производные: отщепляется галогенводород и образуется двойная связь:
H3C-CH2-CH2BrH3C-CH=CH2+NaBr+H2O
Бромистый пропил Пропилен
Если в α-положении к атому углерода, связанному с галогеном, находится третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева):
H3C-C-CI H3C-C + KCL + H2O
2,3-Диметил-3-хлорпентан 2,3-Диметелпентен-2
Это связано с термодинамической устойчивостью образующихся алке-нoв. Чем больше заместителей имеет алкен у винильных атомов углерода, тем выше его устойчивость.
2. Действием на спирты водоотнимающих средств: а) при пропускании спиртов над окисью алюминия при 300-400° С.
НзС-СН-СН2.-СНзНзС-СН=СН-СНз
Втор -Бутиловый спирт
б) при действии на спирты серной кислоты в мягких условияхреакция идет через промежуточное образование эфиров серной кислоты:
НзС-СН-СНз НзС-СН-СН3 H3C-CH=CH2
изопропнлопып спирт
При дегидратации спиртов в жестких условиях в кислых средах наблюдается та же закономерность в отщеплении водородных атомов разного типа, как и при отщеплении галогенводорода.
Первой стадией этого процесса является протонирование спирта, после чего отщепляется молекула воды и образуется карбкатион:
СНз-СН2-СН-СНз + H CH3-CH2-CH-CH3 CH3-CH-CH-
CH3CH3-CH-CH-CH3CH3-CH=CH-CH3
Образовавшийся карбкатион стабилизируется выбросом протона из соседнего положения с образованием двойной связи (β-элиминирование). В этом случае тоже образуется наиболее разветвленный алкен (термодинамическиболее устойчивыи). При этом процессе часто наблюдаются перегруппировки карбкатионов связанные с изомеризацией углеродного скелета:
CH3 C-CH – CH3 CH3 C-CH-CH3
3. При действии Zn или Mg на дигалогенпроизводные с двумя
атомами галогена у соседних атомов углерода:
H3C – C CH2CIH3C - C - CH2+MgCI2
1,2-дихлор-2-метал- изобутилен
4. Гидрированием ацетиленовых углеводородов над катализаторами с пониженной активностью (Fe или «отравленные», т. е. обработанные серусодержащнми соединениями для понижения каталитической активности, Pt и Pd):
НСС-СН(СНз)2Н2С=СН-СН(СНз)2
2.3 Представители алкенов.
Как и алкаиы, низшие гомологи ряда простейших алкенов при обычных условиях - газы, а начиная с С5 - низкокипящие жидкости (см. табл.).
Все алкены, как и алканы, практически нерастворимы в воде и хорошо растворимы в других органических растворителях, за исключением метилового спирта; все они имеют меньшую плотность, чем вода.
Содержащие пи-связь - это непредельные углеводороды. Они являются производными алканов, в молекулах которых произошло отщепление двух атомов водорода. Образовавшиеся свободные валентности формируют новый тип связи, которая располагается перпендикулярно плоскости молекулы. Так возникает новая группа соединений - алкены. Физические свойства, получение и применение веществ этого класса в быту и промышленности мы рассмотрим в этой статье.
Гомологический ряд этилена
Общая формула всех соединений, называемых алкенами, отражающая их качественный и количественный состав, - это C n H 2 n . Названия углеводородов по систематической номенклатуре имеют следующий вид: в термине соответствующего алкана изменяется суффикс с -ан на -ен, например: этан - этен, пропан - пропен и т. д. В некоторых источниках можно встретить еще одно название соединений этого класса - олефины. Далее мы изучим процесс образования двойной связи и физические свойства алкенов, а также определим их зависимость от строения молекулы.
Как образуется двойная связь
Электронную природу пи-связи на примере этилена можно представить следующим образом: атомы карбона в его молекуле находятся в форме sp 2 -гибридизации. В этом случае формируется сигма-связь. Еще две гибридные орбитали - по одной от атомов углерода, формируют простые сигма-связи с водородными атомами. Два оставшихся свободных гибридных облака атомов карбона перекрываются над и под плоскостью молекулы - образуется пи-связь. Именно она определяет физические и химические свойства алкенов, речь о которых пойдет далее.

Пространственная изомерия
Соединения, имеющие один и тот же количественный и качественный состав молекул, но различное пространственное строение, называются изомерами. Изомерия встречается в группе веществ, называемых органическими. На характеристику олефинов большое влияние оказывает явление оптической изомерии. Она выражается в том, что гомологи этилена, содержащие у каждого из двух углеродных атомов при двойной связи различные радикалы или заместители, могут встречаться в форме двух оптических изомеров. Они отличаются друг от друга положением заместителей в пространстве относительно плоскости двойной связи. Физические свойства алкенов в этом случае также будут разными. Например, это касается температур кипения и плавления веществ. Так, олефины неразветвленного строения углеродного скелета имеют более высокие температуры кипения, чем соединения-изомеры. Также температуры кипения цис-изомеров алкенов выше, чем транс-изомеров. В отношении температур плавления картина противоположная.
Сравнительная характеристика физических свойств этилена и его гомологов
Первые три представителя олефинов являются газообразными соединениями, затем, начиная с пентена C 5 H 10 и до алкена с формулой C 17 H 34 , - жидкости, а далее идут твердые вещества. У гомологов этена прослеживается следующая тенденция: температуры кипения соединений снижаются. Например, у этилена этот показатель равен -169,1°C, а у пропилена -187,6°C. Зато температуры кипения с увеличением молекулярной массы повышаются. Так, у этилена она равна -103,7°C, а у пропена -47,7°C. Подводя итог сказанному, можно сделать вывод, звучащий кратко: физические свойства алкенов зависят от их молекулярной массы. С ее увеличением изменяется агрегатное состояние соединений в направлении: газ - жидкость - твердое вещество, а также снижается температура плавления, а температуры кипения возрастают.

Характеристика этена
Первый представитель гомологического ряда алкенов - это этилен. Он является газом, малорастворимым в воде, но хорошо растворяющимся в органических растворителях, не имеющим цвета. Молекулярная масса - 28, этен немного легче воздуха, имеет едва уловимый сладковатый запах. Он легко вступает в реакции с галогенами, водородом и галогеноводородами. Физические свойства алкенов и парафинов тем не менее достаточно близки. Например, агрегатное состояние, способность метана и этилена к жесткому окислению и т. д. Как же можно различить алкены? Как выявить непредельный характер олефина? Для этого существуют качественные реакции, на которых мы и остановимся подробнее. Напомним, какую особенность в строении молекулы имеют алкены. Физические и химические свойства этих веществ определяются наличием в их составе двойной связи. Чтобы доказать ее присутствие, пропускают газообразный углеводород через фиолетовый раствор перманганата калия или бромную воду. Если они обесцветились, значит, соединение содержит в составе молекул пи-связи. Этилен вступает в реакцию окисления и обесцвечивает растворы KMnO 4 и Br 2 .
Механизм реакций присоединения
Разрыв двойной связи заканчивается присоединением к свободным валентностям карбона атомов других химических элементов. Например, при взаимодействии этилена с водородом, называемом гидрогенизацией, получается этан. Необходим катализатор, например порошковидный никель, палладий или платина. Реакция с HCl заканчивается образованием хлорэтана. Алкены, содержащие более двух атомов углерода в составе своих молекул, проходят реакцию присоединения галогеноводородов с учетом правила В. Марковникова.

Как гомологи этена взаимодействуют с галогеноводородами
Если перед нами стоит задание "Охарактеризуйте физические свойства алкенов и их получение", нам нужно рассмотреть правило В. Марковникова более подробно. Практическим путем установлено, что гомологи этилена реагируют с хлороводородом и другими соединениями по месту разрыва двойной связи, подчиняясь некоторой закономерности. Она заключается в том, что атом водорода присоединяется к наиболее гидрогенизированному углеродному атому, а ион хлора, брома или йода - к карбоновому атому, содержащему наименьшее количество атомов водорода. Эта особенность протекания реакций присоединения получила название правила В. Марковникова.
Гидратация и полимеризация
Продолжим далее рассматривать физические свойства и применение алкенов на примере первого представителя гомологического ряда - этена. Его реакция взаимодействия с водой используется в промышленности органического синтеза и имеет важное практическое значение. Впервые процесс был проведен еще в XIX веке А.М. Бутлеровым. Реакция требует выполнения ряда условий. Это, прежде всего, использование концентрированной серной кислоты или олеума в качестве катализатора и растворителя этена, давление порядка 10 атм и температура в пределах 70°. Процесс гидратации происходит в две фазы. Вначале по месту разрыва пи-связи к этену присоединяются молекулы сульфатной кислоты, при этом образуется этилсерная кислота. Затем полученное вещество реагирует с водой, получается этиловый спирт. Этанол - важный продукт, применяемый в пищевой промышленности для получения пластмасс, синтетических каучуков, лаков и других продуктов органической химии.

Полимеры на основе олефинов
Продолжая изучать вопрос применения веществ, относящихся к классу алкенов, изучим процесс их полимеризации, в котором могут участвовать соединения, содержащие непредельные химические связи в составе своих молекул. Известно несколько типов реакции полимеризации, по которым происходит образование высокомолекулярных продуктов - полимеров, например таких как полиэтилен, полипропилен, полистирол и т. д. Свободнорадикальный механизм приводит к получению полиэтилена высокого давления. Это одно из наиболее широко применяемых соединений в промышленности. Катионно-ионный тип обеспечивает получение полимера стереорегулярного строения, например полистирола. Он считается одним из наиболее безопасных и удобных в использовании полимеров. Изделия из полистирола устойчивы к агрессивным веществам: кислотам и щелочам, негорючие, легко окрашиваются. Еще один вид механизма полимеризации - димеризация, он приводит к получению изобутена, применяемого в качестве антидетонационной добавки к бензину.
Способы получения
Алкены, физические свойства которых мы изучаем, получают в лабораторных условиях и промышленности различными методами. В опытах в школьном курсе органической химии используют процесс дегидратации этилового спирта с помощью водоотнимающих средств, например таких, как пятиокись фосфора или сульфатная кислота. Реакция проводится при нагревании и является обратной процессу получения этанола. Еще один распространенный способ получения алкенов нашел свое применение в промышленности, а именно: нагревание галогенопроизводных предельных углеводородов, например хлорпропана с концентрированными спиртовыми растворами щелочей - гидроксида натрия или калия. В реакции происходит отщепление молекулы хлороводорода, по месту появления свободных валентностей атомов карбона образуется двойная связь. Конечным продуктом химического процесса будет олефин - пропен. Продолжая рассматривать физические свойства алкенов, остановимся на главном процессе получения олефинов - пиролизе.

Промышленное производство непредельных углеводородов ряда этилена
Дешевое сырье - газы, образующиеся в процессе крекинга нефти, служат источником получения олефинов в химической промышленности. Для этого применяют технологическую схему пиролиза - расщепление газовой смеси, идущее с разрывом углеродных связей и образованием этилена, пропена и других алкенов. Пиролиз проводят в специальных печах, состоящих из отдельных пирозмеевиков. В них создается температура порядка 750-1150°C и присутствует водяной пар в качестве разбавителя. Реакции происходят по цепному механизму, идущему с образованием промежуточных радикалов. Конечный продукт - это этилен или пропен, их получают в больших объемах.

Мы подробно изучили физические свойства, а также применение и способы получения алкенов.